作者:孙千 本文转载自公众号:老千和他的朋友们。原文地址:https://mp.weixin.qq.com/s/QyCtlRQrl9iJ3cKkI9uU4Q
体电子显微镜(vEM,又称 volume EM)是生物医学研究里常用的超高精度成像技术,能把细胞、组织,还有线虫、果蝇这类小型生物的三维结构,以纳米级分辨率清晰展现,被《自然》杂志列为 2023 年值得关注的七大技术之一。

要明确vEM的技术范围,通常这么定义:在电镜下,对树脂包埋的细胞或组织做连续深度超1微米的系列成像,不管具体成像方式。
vEM主要分两类,一类基于透射电镜(TEM),另一类基于扫描电镜(SEM)。基于 TEM 的技术,主要有连续切片透射电镜(ssTEM)和连续切片电子断层扫描(ssET);基于SEM的技术更多样,包括阵列断层扫描、连续块面扫描电镜(SBF-SEM,又称 SBEM)、FIB-SEM等。这些技术拍下的系列图像,叠加处理后就能生成样品原本的三维数字模型。
另外,还会介绍几种新兴 vEM 技术,比如自动化连续切片透射电镜(TEMCA 和 GridTape TEM)、快速离子束技术(像PFIB 等),还有 SEM 中能同时拍摄多个区域的大规模成像技术(多束SEM、FAST-EM)。
一开始,vEM主要服务于连接组学研究 —— 这门学科专门探究大脑神经元的连接方式,核心要解决两个问题:一是得覆盖足够大的范围,才能完整捕捉神经元的长度;二是得达到足够高的精度,才能看清神经元间传递信号的关键结构(突触)。后来,样品制备方法有了革新,切片实现了自动化,电子源和探测器得到升级,再加上能高效处理海量图像数据的计算机技术,这些一起为 vEM 的技术突破和普及打下了坚实基础。
如今,vEM 在三维生物结构解析中的作用越来越重要,应用早超出连接组学:能研究大脑神经元,观察细胞结构和肝脏、肺部等非脑组织,帮着做感染机制、免疫学、癌症、阿尔茨海默病等神经退行性疾病的研究,还在发育生物学、植物研究、合成生物学、生物材料及临床研究等多个领域发挥关键作用。
vEM 技术的开发和使用者来自不同研究领域,一开始很难形成统一的技术社群。但过去十年里,不少跨领域的基层合作,把技术专家、电镜技术员、计算机科学家、生物学家和临床医生聚到一起,共同推动 vEM 发展——比如欧洲分子生物学组织(EMBO)和电镜厂家常支持举办专题研讨会,全球还自发组建了多个工作组,专门开展 vEM 相关的研究、开发与应用协作。
本文会一步步介绍从活体生物样品到生成三维图像模型的核心原理和实操步骤,包括样品制备、不同vEM技术的实验流程,还有vEM海量图像数据的处理与分析方法。同时,也会探讨 vEM 的局限性和vEM图像数据共享的重要性 —— 这既方便别人重复验证实验,也利于数据长期留存,还会给出相关难题的解决方案。最后会展望 vEM 在研究大脑、器官等复杂生物系统时面临的挑战与机遇。
1 实验流程
一次 vEM 实验包含多个关键步骤(见图 1),每一步都得精心规划,才能最大限度提高实验成功率。需要确定并优化的核心步骤有 6 步:
- 选择生物样品与实验条件(要考虑 vEM 技术复杂,没法做大量重复样品实验);
- 挑选 “探针”:也就是能标记样品中目标区域(比如某类细胞器),还能补充分子层面信息的工具;
- 样品制备:既要尽量保持样品的活体状态,又要让它适配电镜成像环境;
- 样品跟踪与修剪:聚焦到目标研究区域,给后续成像提供便利;
- 选择vEM 成像模式:要匹配所需的成像范围与图像清晰度;
- 确定数据分析的难度与规模:确保分析结果能解释生物层面的相关问题。
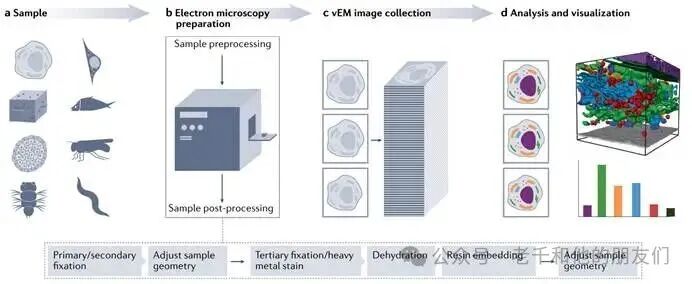
图 1. 典型的vEM工作流程:样品特性、目标结构及研究问题决定vEM工作流程的整体设计
vEM 能研究的样品类型很广,包括分离细胞、细胞单层、斑马鱼、黑腹果蝇等模式生物,还有类器官、组织等。
这些样品得经过复杂制备,才能成为 vEM 成像用的样本:先通过化学或低温固定尽量保持样品天然状态,关联vEM流程中,通常还会在vEM处理前(固定前或固定后)做光学显微镜成像;大型样品要调整几何形态,以适配后续染色(受试剂渗透限制);之后接触特定重金属混合液,经脱水、树脂包埋,包埋后再根据目标成像模式调整几何形态。
所有 vEM 模式最终都会生成连续图像系列,后续要利用开源及商用软件里的手动、半自动化、自动化算法,对图像体进行重建、分析和可视化。
2 样品制备
我们把初始生物材料叫 “样品(sample)”,经处理后能用于成像的材料叫 “样本(specimen)”。vEM 成像成功与否,很大程度上取决于样品制备的质量。优质的制备方案要满足两个核心要求:一是尽量保持样品的天然状态,二是让样品适配电镜的成像环境。
具体来说,样本得具备三项关键特性:能耐受电镜内的真空环境和电子束/离子束的高能量冲击;能提供足够的图像对比度(保证细节清晰可见);结构要具备足够刚性(尤其针对需要切薄片的样品)。
不同实验室会根据样品特性、目标观察结构及成像模式调整制备方案,所以方案差异较大。下面详细介绍样品制备的核心步骤:样品大小调整、样品固定、染色、脱水与树脂包埋、树脂块修剪、连续切片的制备和收集。
2.1 样品大小调整
样品的最大尺寸由固定剂和染色剂的渗透深度决定,一般建议样品至少一个维度的厚度不超 1 毫米(用定制微波炉提高试剂渗透速度,能打破这个限制)。比如,生长在玻璃或塑料表面的细胞单层不用调整,厚度约10微米;血液中的细胞等细胞悬液,可通过离心形成大小合适的细胞团。线虫、果蝇、斑马鱼等毫米级小型生物,能直接解剖后成像或整体成像;肝脏组织等厘米级组织,通常要切成小块,或用振动切片机切成薄片,但完整的小鼠大脑也已成功用于 vEM 研究。
2.2 样品固定
固定的核心目的是保持样品的天然状态,具体用哪种方法,要根据生物结构的脆弱程度和样品大小来定:
化学固定(OTO 法):用 2%-4% 的无甲醇甲醛与 1%-4% 的戊二醛混合液浸泡样品,操作简单,但很难捕捉细胞膜管状化等快速发生的细胞内部活动。这种方法通过醛类和四氧化锇等化学物质,与蛋白质和脂类形成交联,低温下延长固定时间,能减少固定液对组织的抽提作用。其中,OTO(osmium tetroxide-TCH-osmium tetroxide)法利用硫代甲酰二肼(TCH)的桥连作用,增加重金属锇在细胞膜上的含量,提升对比度,还能搭配硝酸铅和醋酸双氧铀在 50℃下块染,增强衬度与导电性。要注意,TCH 反应释放的 N₂可能破坏样品内部结构。
高压冷冻与冷冻替代:先通过高压(2100 bar 以上)液氮在毫秒级别快速冷冻样品,抑制冰晶形成,让水分以玻璃化状态存在,最大程度保持样品真实结构。这种方法适合含水量大或难渗透的样品(如水熊虫、线虫、部分植物),最佳冷冻深度可达 200μm,但理想无冰晶区域仅接近样品盘表面 50μm 左右。冷冻后要在低温下用有机溶剂(常用 1% 四氧化锇 – 丙酮溶液)进行冷冻替代脱水,恢复室温后,可通过 0.5% 醋酸铀 – 丙酮溶液块染,再进行后续浸透、包埋步骤。
固定方法的选择主要看样品初始大小:高压冷冻只适用于约 200 微米的小样品;毫米级样品可通过浸泡进行化学固定;小鼠等较大生物则能通过血管注射固定剂实现固定。所以,细胞单层、细胞悬液、线虫、果蝇等小体量样品特别适合用高压冷冻固定。
关于固定方法的详细选择指南,可参考相关专业文献。
2.3 染色(增强对比度)
染色是 vEM 实验的关键步骤,核心目的是提升生物样品在电镜下的清晰度,既要让细胞膜等结构清晰可辨,也要赋予样品导电性。
所需的染色深度要根据 vEM 技术类型调整:
基于 TEM 的技术:不用深度染色,一方面是因为探测器有了改进,另一方面是图像由电子穿透样品形成;
基于离子束的技术:需要中等深度染色,因为图像由反射电子形成;
原位切片机技术:需要深度染色,以减少生成背散射电子图像所需的束剂量,避免样品充电变形或树脂开裂。
不同实验室的染色配方差异较大,但多数会用含重金属盐的溶液浸泡样品来增强对比度,常用试剂有铀、镧系元素、锇(分为还原型和水性两种)、硫代卡巴肼、单宁酸、邻苯三酚等。如果实验允许轻度染色,只用铀盐就行;但多数样品需要深度染色 —— 先依次用还原型锇、硫代卡巴肼、锇处理,再用铀盐与天冬氨酸铅浸泡。这些染色配方都是在历史研究基础上改进来的,目前针对特定样品的新配方也在不断出现。此外,由于部分国家禁止使用铀,相关替代染色剂的开发工作也在推进。
2.4 脱水与树脂包埋
这一步骤的目的是保护样品免受电镜真空环境的损伤,同时为后续制备超薄切片(通常厚度在 100 纳米以内)提供便利,具体要完成两项工作:
脱水:去除样品中的水分,所用溶剂要与后续的树脂兼容 —— 化学固定的样品通过梯度浓度的乙醇或丙酮脱水;高压冷冻的样品则在 “冷冻置换” 过程中同步完成脱水与染色;
包树脂:脱水后,用梯度浓度的树脂逐步渗透样品,再通过加热或紫外线照射让树脂硬化。
环氧树脂(如 Durcupan、Spurrs、Epon 812、Hard Plus)因为具备优异的样品渗透性能和成像稳定性,成为最常用的树脂类型;如果需要保留样品中荧光蛋白的发光特性,则可选用甲基丙烯酸酯树脂(如 Lowicryl HM20、LR White)。
树脂的配方很关键,环氧基与硬化剂的反应基比率决定聚合链长度和树脂块切割性能。偏硬的树脂利于连续切片收集,但展片困难;偏软的树脂展片容易,却不利于薄切片收集。样品与树脂的硬度差也可能导致切片褶皱,需要根据样品调整配方,以实现 30~50 nm 序列切片的稳定收集。
2.5 树脂块修剪
样品包埋树脂后,要修剪成适配成像的大小与形状 —— 要么便于切超薄切片,要么便于直接研磨成像。修剪需要用超薄切片机上的玻璃或金刚石刀手动操作,包括粗修和精修,要尽量修掉兴趣区域外多余的树脂,避免因硬度差导致切片褶皱;单层细胞样品修块时,避免修整顶面,只修四个侧面。
多数情况下,修剪前要明确目标结构的位置,避免修剪偏差。这时通常会结合荧光显微镜或X射线显微镜(特殊情况下),先定位目标结构,再依据标记进行修剪。修剪完成后,可直接用 vEM 成像,或根据后续成像需求,用金刚石刀将样品切成超薄切片。
此外,在树脂硬化前去除多余树脂,或给样品涂抹一层导电涂层,既能减少修剪工作量,还能通过观察表面结构辅助定位生物组织。对于大型树脂包埋样品,也可以用热刀切开,分成小块进行 vEM 成像。
2.6 连续切片的制备和收集
连续切片的制备和收集需要借助专用设备,核心包括超薄切片机、电动轮式传输带、控制计算机、防震台、除静电装置及自动补水装置等,代表性技术有哈佛大学开发的 ATUM-SEM 和中国科学院生物物理研究所开发的 AutoCUTS-SEM。
收集带类型:常用 Kapton-PET 收集带(表面平整、不导电)和 Carbon-PE 收集带(表面不平整、导电);中国科学院自动化研究所开发的连续薄膜条带镀碳技术,可在 Kapton-PET 收集带上镀导电碳膜,兼顾平整性与导电性。收集带需通过卷轴式等离子清洗仪进行亲水化处理,要调整条带转动速度、等离子处理功率和时间以适配不同条带。
切片收集器:主要有基于 RMC 超薄切片机的 ATUMtome 和基于 Leica 超薄切片机的 AutoCUTS,包括主体、控制面板和注水泵三部分。安装时将收集带导轨支架置于钻石刀槽上方外侧,收集带自下而上绕过支架连接供带盘轴与收带盘轴,调节松紧后即可启动收集。
装订与导电处理:将载有切片的收集带通过双面碳导电胶带粘贴在硅晶圆片上;如果使用 Kapton-PET 收集带,需通过高真空镀膜仪镀碳(厚度约 6 nm)以提升导电性,处理后放在干燥柜备用。
3 探针(标记目标结构的工具)
vEM 技术能够将样品的形态与分子信息(如某类蛋白的分布位置)相结合。理想的标记工具需满足三项要求:能在样品全深度范围内定位目标分子;检测精度可达分子级别;且不破坏样品的天然环境。这一要求虽具挑战性,但通过基因编码标签的开发与应用已逐步实现。
基因编码标签
基因编码标签经基因改造制备,在 vEM 下呈深色,常用类型包括金属硫蛋白基探针、reASH、miniSOG 及 APEX/APEX2。APEX2 为 APEX 的改进版,细胞内 / 外及细胞器腔室均具活性,应用场景涵盖目标蛋白直接标记、纳米抗体定位 GFP/RFP 标记蛋白、拆分法标记特定蛋白复合物,核心原理是将可溶性二氨基联苯胺(DAB)转化为不溶性深色物质以适配电镜观察。
该标签适用于化学固定样品与冷冻电镜方案(cryoAPEX),兼容细胞、组织及动物样品,可实现多细胞同时标记,其诱导 DAB 形成的深色物质还能促成金颗粒生成,支持单分子检测。金属硫蛋白标签同样具备金颗粒诱导能力,适配多种 vEM 技术。
其他标记工具
荧光基因编码标签可通过关联光镜– 体电镜(vCLEM),直接或间接用于 vEM 结构定位;抗体与神经示踪剂(神经元发光探针)可实现 vEM 下细胞器与细胞标记。新型免疫标记法无需破坏样品完整性,可对 1 毫米厚组织切片进行标记,既保留精细结构,又能通过 SBF-SEM 结合 vCLEM 收集分子信息。
阵列断层扫描通过切片标记解决染色剂在湿润组织中渗透深度有限的问题,该方法依赖电镜兼容抗体,且需保证样品制备过程中抗体结合位点(表位)不被破坏。神经示踪剂、荧光标记蛋白与切片免疫标记结合可实现 vEM 多重标记;ssTEM 的多重标记策略为:从超薄切片系列中选取少量样品,经免疫组织化学或免疫金标记后,将其分子信息推广至全系列切片。
4 基于TEM的vEM技术
基于TEM的vEM 成像(见图 2)有两大优势:一是分辨率高且不损伤样品,二是可通过 CCD 或 CMOS 相机进行全场采集(无需逐点扫描),速度更快。但 TEM 存在一个限制:样品不能过大过厚,因此需先用金刚石刀将样品切成长条状的超薄切片,再放置到直径 3 毫米的载网上。
该技术具体分为三类,各有其原理、优缺点及最新进展,具体见下表所示。
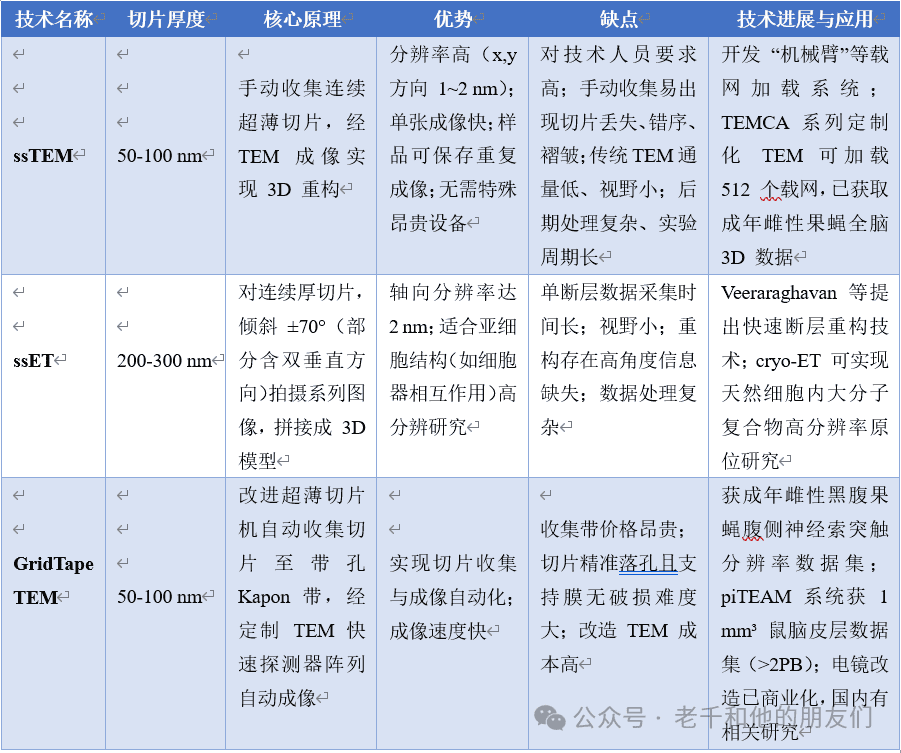
这三种技术均需对连续切片逐一拍照,再将图像叠加形成样品的三维模型。早期技术存在成像速度慢、依赖人工操作、技术门槛高等问题,成像范围受限,而 GridTape TEM 等新技术为其注入了自动化、高通量的活力,但也给数据处理与分析带来了新挑战。
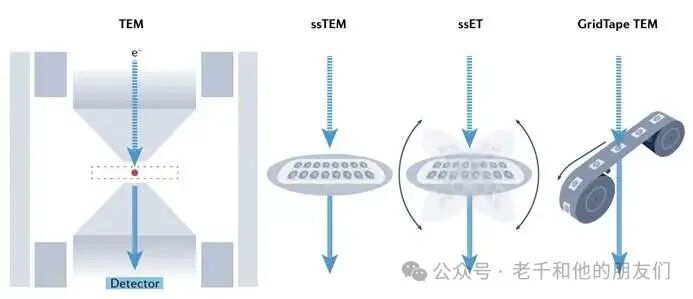
图 2 体电子显微镜(vEM)的TEM成像模式
50-70 纳米连续超薄切片收集于带电子透明支撑膜的铜制载网(ssTEM);200-300 纳米厚切片多倾斜成像,经反向投影重建三维体积(ssET);胶带支撑系统将大量超薄切片直接送入镜筒成像(GridTape TEM)。
5 基于 SEM 的 vEM 技术
基于 SEM 的 vEM 成像(见图3)的优势在于成像范围广,且电镜腔室足够大,可容纳大型样品架与原位切片设备。目前,基于SEM的vEM技术应用最为广泛,部分技术操作简便,能常规拍摄出兼具精细结构与大范围的图像。
当前主要有三种技术路径,各具特色:
- 原位切片机技术(如 SBF-SEM);
- 离子束技术(如 FIB、pFIB、eFIB-SEM);
- 阵列断层扫描(含ssSEM、ATUM-SEM、AutoCUTS-SEM)。
这三种技术均需满足三项基本要求:样品具备足够对比度;使用场发射枪扫描电镜(能在 1-2 keV 的低电压下成像,且配备背散射或二次电子探测器);拥有专用软件与稳定系统,可连续成像数天、数周甚至数月。
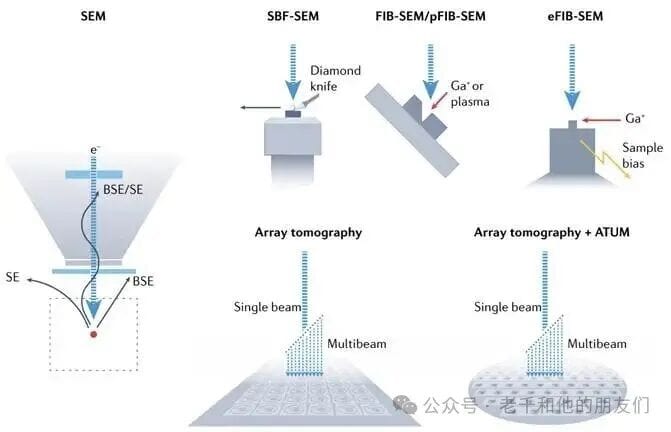
图3 体电子显微镜(vEM)的SEM成像模式
腔室内小型超薄切片机连续切割成像(SBF-SEM);镓离子束或等离子体研磨成像(FIB-SEM、pFIB-SEM),部分整合样品偏压等增强功能(eFIB-SEM);超薄切片收集于硅片等基底(结合 ATUM),经单/多并行电子束SEM成像(阵列断层扫描)。
5.1 原位切片机技术(以 SBF-SEM 为例)
据了解,目前有四款商用 SBF-SEM 产品可供选择:3View(原Gatan公司,现隶属于Ametek,已停产)、Volume Scope(Thermo Fisher Scientific公司)、Katana(ConnectomX 公司)、Volutome(ZEISS公司),此外还有多种自制解决方案。
它们的核心原理一致:在 SEM 腔室内安装小型超薄切片机,切片机上固定金刚石刀,让刀在树脂块上来回切割;同时树脂块沿 z 轴逐步向上移动,移动步长决定切片厚度(最小可至25 nm,Volume Scope 的多能反卷积 MED-SEM 可将 z 轴分辨率提高到 <10 nm)。若需拍摄大范围图像,可通过在腔室内移动整个切片机,将多张图像拼接而成。
这种技术的优势是成像体积比 FIB-SEM 大、效率高,图像配准简单,应用于神经科学和其他生物学领域。但也存在明显不足:工作距离不够理想,会影响成像分辨率(横向分辨率约 5 nm)与探测器选择;且样品块若导电性不佳,会产生带电现象,导致图像变形(即 “充电效应”),切片时还可能出现颤痕或不完整等缺陷。
早期的原位切片机通过 SEM 的 “可变压力” 减轻充电问题 —— 该问题在含大面积不导电空白树脂的样品(如细胞聚团或肺组织)中尤为突出。如今的新型仪器则采用聚焦电荷补偿系统,通过在样品表面局部吹气流减轻充电,扩大了可成像样品的范围;对于图层丢失或污染问题,可在图像采集过程中增加碎片检测和清理步骤。
5.2 离子束技术(以 FIB-SEM 为例)
在原位切片机发展的同时,科研人员与厂家还尝试利用镓 FIB 在 SEM 中为树脂块 “切割” 薄片。其原理是原位利用聚焦镓离子束铣削感兴趣的微小区域表面,暴露后自动获取背散射电子成像,对齐配准后实现生物样品 3D 重构。
这种方法并非采用机械切割,而是通过电子控制的离子 “研磨” 样品表面,具备两大优势:一是切片厚度更薄(原位切片机通常切割 50 纳米,FIB-SEM 可切割至 5 nm),z 轴分辨率高(可达 5 nm,接近 ET 分辨率),能生成各向同性体素 —— 即三维像素的长、宽、高完全一致,后续自动分析结构时不易出现误差,且切片缺陷(破损、褶皱、丢失等)相对较少,原位切割利于后期图像对齐配准;二是电子束传递给成像表面的负电荷可通过随后离子束带来的正离子减轻,因此可用于成像对比度差的样品。
但需注意的是,离子束是从侧面 “研磨” 样品,与其他切片技术的切割方向垂直,因此实验设计时需确保目标成像区域能被电子束扫描到。此外,镓离子切割的能力和有限速度,影响了该技术的视野和通量,长时间操作对仪器稳定性和样品形变也有考验,因此更适用于小体积生物样品(特别是亚细胞水平)的 3D 重构,如酵母细胞各细胞器分布、内质网与其他细胞器的相互作用等研究。
为提升成像速度与效率,相关技术不断优化:2017 年美国 HHMI 珍妮莉亚研究园区开发了增强型 FIB-SEM 系统(eFIB-SEM),通过样品台正向偏置提高成像速度、引入多层错误保护措施、采用离子束闭环控制保持稳定性、调整离子束与电子束夹角缩短工作距离,还可通过热刀技术将标本分切成多个包埋块并行成像,已获得高分辨率的果蝇视叶组织和多种细胞、组织数据集。
近年来,等离子体 FIB(pFIB)、气团离子束等设备陆续推出,使用氧、氙、氩、氮等离子切割生物标本,切削速度更快、面积更大,提高了 FIB-SEM 的研究尺度(pFIB 切割尺度可 >100 μm)。
值得一提的是,FIB-SEM 在低温应用领域也日益增多。cryo-FIB 已广泛用于为 cryo-ET 制备薄的细胞 “片层”;cryo FIB-SEM 可在低温下直接对快速冷冻或高压冷冻后玻璃化的细胞或组织样品进行连续成像,避免化学试剂、脱水、重金属进入导致的形变和假象,获得更真实的生物 3D 结构,其与高分辨率 Cryo-ET 结合的潜力备受期待。
5.3 阵列断层扫描(含 ssSEM、ATUM-SEM、AutoCUTS-SEM)
与原位切片机、离子束 “边切边拍” 的模式不同,阵列断层扫描需先将样品切成超薄连续切片,在固体基底上摆成二维阵列后,再用 SEM 拍照。切片通常通过标准超薄切片机切割,随后放置在硅片、带碳涂层的盖玻片或带氧化铟锡涂层的盖玻片上。
ssSEM(连续切片扫描电镜成像技术)
又称 Array tomography,手动收集连续切片技术难度大,易造成切片缺陷,仅适用于少量切片(<500 片)的收集。为提高切片通量,先后出现了ASH-100、硅片提升装置、改良刀、“Arraybot” 计算机控制收集、“MagC” 磁性收集,以及商业化的 ARTOS 3D 超薄切片机(徕卡公司)、ASH2 硅片夹持工具(阿姆西公司)等半自动收集措施。
高通量快速成像是实现大规模体电子显微学研究的关键。目前,商业化的解决方案正日益成熟,主要通过三类技术路径实现:多束扫描电镜(如MultiSEM、Fast-EM)、高速扫描电镜(如Navigator SEM-100、HEM6000),以及多台电镜并行采集系统。
在高速扫描电镜这一技术方向上,国仪量子技术(合肥)股份有限公司推出的HEM6000体现了显著的自主技术集成与工程优化。该设备采用了高亮度肖特基场发射电子枪、高速静电偏转扫描系统,并融合了高压样品台减速与动态光轴等设计,旨在实现纳米级高分辨率的同时,大幅提升成像速度。其图像采集速度最高可达2*100 M pixel/s,像素驻点时间最短为10ns,综合成像效率可达常规场发射扫描电镜的5倍以上,为连续、大视场的图像采集提供了硬件基础。

西湖大学生物医学实验技术中心—国仪量子HEM6000高速扫描电镜平台
针对连续切片或自动条带收集的切片样品的扫描成像工作流程,HEM6000在系统稳定性与软件自动化方面也进行了优化。其自主研发的高压电源与低噪声直接电子探测器,确保了长时间、大数据量采集过程中图像质量的均匀性与一致性。集成的自动化多视场拼接与连续成像功能,有效支撑了从数百张切片样品载入到数据自动采集和分析的一体化作业。这使得该设备能够胜任毫米级生物组织(如小鼠脑、植物样本等)的纳米分辨率三维重构任务。
此外,由于 ssSEM 切片和成像分离,特别适用于光电关联技术(CLEM),可将光镜获取的分子信息与细胞超微结构结合,实现结构和功能的完美结合。
ATUM-SEM 与AutoCUTS-SEM
ATUM-SEM 与 AutoCUTS-SEM是自动化程度最高、切片收集通量最大的阵列断层扫描技术。ATUM-SEM 由美国哈佛大学 Jeff Lichtman 团队开发,AutoCUTS-SEM 由中国科学院生物物理研究所生物成像中心孙飞团队开发,两者工作原理类似:使用常规超薄切片机进行树脂样品的连续切片,用连续转动的条带进行切片收集,将收集的切片带粘贴到晶片上,经导电处理后转移至 SEM 中获取序列图像。目前两者均已商业化,助力于小鼠脑组织、斑马鱼、线虫、青芊花粉粒、猴视网膜组织、血管组织、苜蓿根瘤等多种样品的研究,尤其在捕捉机体内的小概率事件中发挥重要作用。

6 多 vEM 技术结合的工作流程
有时,根据研究问题、样品大小及目标观察结构的不同,需采用多尺度、多分辨率的成像流程(见图 3),此时将多种vEM技术结合使用效果更佳。例如,可先用 SBF-SEM 进行智能修剪—— 定位目标研究小区域,再通过 FIB-SEM、TEM 或 nanoSIMS(可分析样品成分)拍摄更高精度的图像。还有一些混合方法会结合厚切片与 FIB-SEM,既能快速扫描大范围样品,又能在目标小区域获取高精度的三维图像。
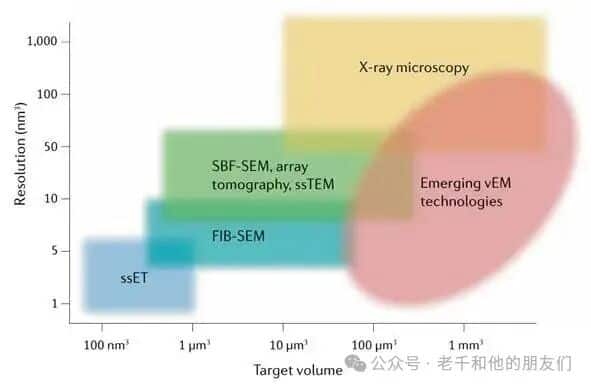
图 3 作为多尺度、多模态成像技术的 vEM
vEM在不断突破高分辨率体积成像的边界。基于 TEM 的成像模式(ssET、ssTEM)通常具有更高分辨率,而基于 SEM 的成像模式(SBF-SEM;阵列断层扫描; FIB-SEM)通常能成像更大体积。多模态工作流程、新兴 vEM 技术(如 GridTape TEM、多束 SEM、增强型FIB-SEM、PFIB-SEM、FAST-EM)以及 X 射线显微镜等相关技术,正进一步扩展体积成像的尺度和分辨率范围。
6.1 关联光镜–体电镜(vCLEM)
vCLEM 是众多 vEM工作流程的核心技术,因为电镜的成像范围远小于大多数生物样品的实际大小。vCLEM 主要有两大用途:一是在光学显微镜和vEM 之间定位并跟踪同一结构;二是确定分子在样品中的位置,进而探究分子功能(见图 4)。
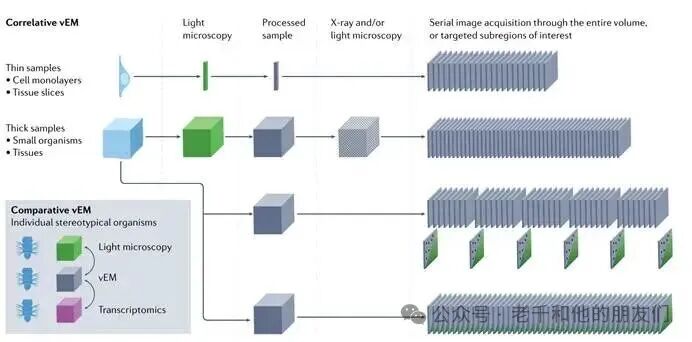
图 4 关联和比较 vEM 在功能 – 结构研究中的应用
vEM 研究常用多模态成像流程:光学显微镜可在电镜处理前获取样品分子、发育或功能信息,还能定位感兴趣区域(ROI)实现靶向成像,或关联分子与结构;薄样品(细胞单层、组织切片)成像体积小,光镜与电镜关联更直接,厚样品需 X 射线显微镜+光镜作为中间步骤,连接高低分辨率数据集并重新定位目标区域。
此外,通过计算分子表型分析或多重 siGOLD 免疫标记,可从 ssTEM 数据集获取丰富功能信息并推广至全数据集;将所有切片用于多成像模式,结合免疫荧光与电子成像,能增强多标记体积成像效果,关联功能鉴定与组织超微结构。对于沙蚕幼虫等结构定型的小型生物,可通过比较分析单个生物的多模态数据,为群体研究得出可靠结论。
结构跟踪需根据样品尺度选择对应方法:单细胞层面通常借助带载网的盖玻片等外部 “坐标系” 大致定位;组织层面因样品体量远大于目标结构,常以血管等明显解剖结构为标记锁定目标;大型样品则可通过高功率激光在样品或树脂块上留下 “面包屑” 式轨迹,顺着标记即可找到单个细胞或目标研究结构。
分子定位主要依靠 vCLEM 技术,通过将树脂包埋后拍摄的荧光蛋白荧光图与 vEM 电镜图叠加,建立分子位置与精细结构的关联,为功能–结构研究提供支撑,目前已开发出能保留树脂包埋后蛋白质荧光特性的方法,可实现荧光与超微结构的精准对齐;
研究还发现荧光蛋白在 SEM 低真空环境下的 “闪烁” 特性,能让分子定位精度达到超分辨率级别,近期通过优化树脂内荧光使用方法,完整且可靠的 vCLEM 工作流程已逐步建立,而 “关联阵列断层扫描” 作为特殊应用,其分子信息(来自抗体、荧光蛋白或神经示踪剂)与电镜图均来自同一张切片,既便于两种图像的精准对齐,又能实现多重分子标记。
7数据采集、处理与分析
7.1 数据采集
vEM 数据采集依赖专用设备与固定流程。商用电镜均配有采集软件,可手动设置电压、探针电流、成像视野、像素大小等参数,这些参数需根据 SEM、TEM、SBF-SEM 等不同成像模式调整。体电子显微镜还需额外软件管理采集流程,控制载物台、超薄切片机或离子束,常用的有 DigitalMicrograph、Atlas 5 等商用软件,以及 SerialEM、SBEMimage 等开源工具,分别适配不同成像需求。
扫描电镜(SEM)可采集背散射电子信号或二次电子信号。二次电子图像的分辨率和采集速度更优,但对切片平整性、重金属染色强度及样品导电性要求更高。图像衬度与信噪比和探测器收集效率、样品工作距离相关;分辨率则取决于样品结构保存状态、电子束束斑尺寸及入射深度,优化这些条件能提升图像质量。
连续切片自动化成像遵循 “导航 – 定位 – 标定 – 采集” 四步。以 AutoCUTS-SEM 为例,先获取整张硅晶圆片的地图,识别每一张切片,再对切片编号定位、标定感兴趣区域,最后自动移位、聚焦并完成图像采集与保存。当前 vEM 成像软件自动化程度较高,有 WaferMapper 等开源工具,也有 Atlas 等商业化产品,但成像时需平衡采集速度、分辨率与成像体积,且高通量成像设备价格昂贵,缺乏成熟商业化验证,目前难以普及。
7.2 数据处理:实现三维结构重构
vEM 数据处理需按研究需求定制流程,核心步骤包括图像拼接、对齐、增强、多模式配准、分割、轴向信息恢复及三维重建,结合传统算法与相关技术处理数据。
图像拼接用于解决高分辨率与大视场的矛盾。电镜成像分辨率越高,视场越小,需移动载物台分块拍摄后合成完整图像。常用方法有三类:频域法将图像转换到频域,通过傅里叶变换和相位相关计算平移,结合最短路径算法优化插值;像素灰度法通过均方误差或归一化互相关度量图像相似性,仅适用于相邻图像仅存在平移的理想情况;特征点法适配电镜图像细节清晰、纹理丰富的特点,可拟合多种变换模型,通过提取 SIFT 特征或 Harris 角点实现拼接。Kaynig 等针对 TEM 图像提出基于多项式拟合非线性形变的拼接方法,提升了大体量鼠脑组织重建的拼接精度。
图像对齐难度因 vEM 技术而异。SBF-SEM 等基于序列块面的成像,无切片褶皱和丢失问题,用简单仿射变换即可对齐;ssTEM 等基于序列切片的成像,切片可能出现扭曲、破损,需精细对齐。早期常用互相关、归一化互相关等方法,“粗到细” 的对齐策略应用广泛;处理复杂非线性对齐时,有 Elastic 算法、SWiFT-IR 算法等。近年来,ssEMnet、SEAMLeSS 等神经网络算法逐步应用,中国科学院自动化研究所团队提出的光流网络方法,解决了切片褶皱或撕裂的对齐问题。
图像增强用于优化 vEM 数据集的质量。vEM 数据集具有维度高、纹理复杂、亮度差异大、噪声多等特点,常用方法有三种:传统方法如对比度受限自适应直方图均衡化(CLAHE),是 Fiji 软件的自带功能,能减少噪声;内容感知恢复根据图像内容调整,提升信噪比;机器学习方法中,SEM 图像采用监督学习,TEM 图像多采用半监督学习(如 Noise2Noise)或无监督学习(如 Noise2Void)。
多模式配准针对 “关联” 或 “多模式” 数据收集场景,需实现不同来源图像的对齐,分为两类:一是重新定位配准,叠加两种成像模式的相似特征,寻找目标研究区域;二是精准分析配准,通过计算方法精准对齐不同模式图像,便于研究标记的细胞或分子。配准需借助基准标记,阵列断层扫描常用细胞核,关联光镜– 体电镜图像多用线粒体或细胞核,常用软件有 3D Slicer、elastix 等。
图像分割是从海量数据中提取有用信息的关键,因 vEM 图像对比度不足、结构形态多样、数据体量大,分割难度较大,主要有三类方案:手动 / 半自动化分割适用于小数据集或大型数据集子集,可使用 ilastik、IMOD 等开源工具,或 Amira、Imaris 等商用软件,处理大体量数据需下采样或裁剪;自动化分割基于机器学习,需大量 “示例分割图” 训练模型,分为语义分割和物体分割,核心架构为 U-Net,工具包括 DeepImageJ 等;训练与后续处理可通过 napari 标注示例图或 FlyWire 校对初始分割结果,多数深度学习方法支持 Python 代码扩展,处理数十 GB 至数百 TB 数据需依赖分布式计算资源。
轴向信息恢复用于解决横纵分辨率各向异性问题。vEM 制样中,连续切片或切面的 z 方向厚度通常为数十纳米,x、y 方向像素可达 10 纳米以下,导致重构结果存在偏差。ssET 和 FIB-SEM 可实现各向同性重建,但往往需降低成像体积;传统插值法易产生伪影,深度学习方法效果更优,其中 IsoVEM 方法基于 Transformer 网络开发,可适配多种电镜模态数据并修复切片瑕疵。
三维重建技术近十年从传统技术转向深度学习。传统方法通过高斯梯度幅值、拉普拉斯高斯算子等提取目标特征,再用随机森林、Adaboost 等机器学习算法分类识别;深度学习中,全卷积神经网络(如 U-Net)提升了分割精度,后续还有 ICv1、3D U-Net 变体等算法。在亚细胞结构分割领域,专用模型可识别线粒体、突触等结构,无监督对比学习(如 SynapseCLR 算法)和视觉分割基础模型(如微调后的 MicroSAM 模型)也已应用于研究。
8 vEM的优势、局限
相较于光学成像,vEM 能在纳米分辨率下呈现细胞、微生物、病毒等的超微结构三维形态,同时获取周围细胞环境信息;相较于传统 2D 切片电镜成像,其三维体成像数据能更精准描述生物个体结构特征,避免单一切片导致的误判,比如 2D 切片中看似多个细胞核或线粒体,3D 重构后可能实为一个。
vEM 具备多尺度适配性,可兼顾数千个细胞的大视野与精细超微结构,适用于细胞群落形态、肿瘤转移、炎症免疫反应、病原体组织内迁移等研究,在神经连接组学领域作用显著;连续切片 SEM 成像等技术还能捕捉线虫 PVD 神经元分支处的内质网结构等罕见现象,这是传统单张切片电镜成像难以实现的。
vEM 无法像荧光显微镜那样检测特定标签或染料的信号,难以解析生命活动的关键功能信息,也无法精准定位未特异性标记的罕见结构;样品需固定处理,仅能捕获离散时刻的细胞图像,不能实时观察生命活动的动态过程。
电镜原始图像为灰度信息,结构区分难度大,后期图像分割依赖专家人工识别,不同研究者可能存在分歧,影响统计分析结果;虽能提供细胞内大分子的位置和结构特征,但多数情况下无法明确其元素组成,需结合蛋白质组学或能谱等其他技术。
vEM 虽可实现毫米级尺度 3D 重构,但难以分析组织以上尺度的生物样品,需先通过光学成像等高通量技术明确生物过程的条件、位置和时间;对毫米级以上大尺度样本的研究,存在周期长、成本高、技术难度大等问题,不适合普通实验室开展。
综上,vEM 无法单独获取所有生物信息,需与荧光显微镜、蛋白质组学、人工智能预测等方法结合,才能更全面地阐释生物学过程。
9 vEM面临的挑战与展望
vEM 发展面临多项挑战。样品制备方面,需解决厚度 1mm 以上大尺度样品的化学固定和高效渗透问题,满足研究尺度增大的需求;成像通量方面,ZEISS、DELMIC 等公司的多束或快速扫描设备价格昂贵,仅少数实验室能购置,需在保证大尺度高通量成像的同时降低设备成本、推动普及;数据处理方面,连续切片非线性形变的对齐精度有待提升,组学数据与各尺度 vEM 形态结构数据的准确映射图谱关系,是未来需研究的内容。
此外,高分辨率高通量成像下的大数据存储与管理、多尺度 3D 形态划分的通用人工智能大模型、统一的 vEM 基础设施和科研社区建设、标准化的技术培训与推广方案等,均需进一步完善。这些挑战的解决,需要结构生物学、体电子显微学、光学成像、临床科学、人工智能、计算机等多学科研究人员开展跨学科合作。
深度学习等人工智能算法已在 vEM 的图像拼接、对齐、轴向信息恢复中发挥作用,未来将进一步拓展至蛋白质、细胞、组织、器官乃至整个机体系统的跨尺度 vEM 图谱绘制和跨层图谱映射。将该图谱映射关系与蛋白质组、转录组、代谢组研究相结合,可形成组学数据在不同尺度空间的多层次 3D 分布网络,建立 vEM 结构形态研究与功能机制研究的关联。
基于组学和 vEM 的大数据挖掘与人工智能方法,将推动跨尺度生物样品形态研究与生命机理、病理研究的结合,与空间蛋白质组学、转录组学及代谢组学的融合,将为 vEM 的空间结构研究增添功能维度,推动该领域迈向功能形态计量学时代。
参考资料
1.Peddie, C.J., Genoud, C., Kreshuk, A. et al. Volume electron microscopy. Nat Rev Methods Primers 2, 51 (2022)
2. https://www.pibb.ac.cn/pibbcn/article/html/20240324体电子显微学前沿
3. Michael Eisenstein Seven technologies to watch in 2023
4. Collinson, L.M., Bosch, C., Bullen, A.et al. Volume EM: a quiet revolution takes shape. Nat Methods 20, 777–782 (2023)


