作者:孙千 本文转载自公众号:老千和他的朋友们。原文地址:https://mp.weixin.qq.com/s/oiqgmksPW-2DyPofYvROcw
在荧光成像领域,显微镜使用者长期面临一个典型且棘手的挑战 —— 样本组织的厚度与质地差异。生物样本中,细胞大小从几微米到数十微米不等,形态更是千姿百态,有的呈球形,有的为梭形,还有的是不规则的多边形,这些差异会直接导致成像时出现伪影:边缘模糊不清、深层结构与浅层结构重叠、全景显微照片中布满散在的离焦点,让目标结构的轮廓难以辨认。
传统荧光显微镜的局限性在此尤为突出:照明光均匀投射在样本上,信号产生的体积远大于物镜的焦平面,就像用手电筒照射一块磨砂玻璃,光线穿透的路径上都会发出荧光,而非仅聚焦点发光(图1a);更关键的是,信号光子在样本内部会发生 360° 无规则散射,焦平面外的杂光与目标信号一同被检测器捕获,进一步降低了图像的对比度和分辨率,让本就复杂的微观结构更加模糊难辨。
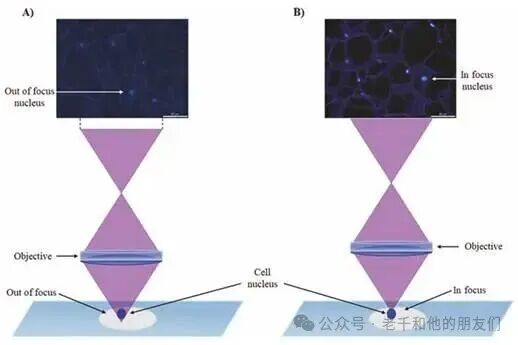
图1 荧光显微镜观察到的植物组织。(a) 厚样本图像,显示焦外干扰和模糊现象;(b) 薄样本产生的聚焦清晰图像。
为破解这一困境,共聚焦显微镜(CM)与多光子显微镜(MM)凭借独特的光学设计与技术原理应运而生,成为生物科学和材料科学领域中,实现高分辨率三维成像的核心工具。
共聚焦显微镜:针孔赋能的精准成像技术
1955 年,马文・明斯基(Marvin Minsky)针对荧光显微镜的模糊问题展开分析,提出了一个开创性构想:“理想的显微镜应逐一检测样本的每个点,并测量该点散射或吸收的光量”。这一构想的核心的是“筛选”—— 只保留焦平面的信号,过滤所有杂光,而实现这一功能的关键部件,便是针孔。
共聚焦显微镜的针孔设计呈现出简洁对称的结构:在照明路径中,激发光经辅助透镜聚焦到第一个针孔,该针孔的孔径与位置经过精密校准,确保物镜能将这一小束光精准投射到样本内部的目标激发点;在样本的透射侧,第二个物镜与针孔相对应,收集物镜会将激发物镜的焦体积精准成像到第二个针孔上,只有焦点处产生的信号光子能顺利穿过针孔到达检测器,样本其他位置散射产生的光子都会被针孔阻挡(图2a)。
如今,更常见的设计是仅用一个物镜同时实现激发与信号收集,利用激发光与荧光的颜色差异进行区分,针孔则介于样本与光检测器之间,像老式相机的光圈一样,灵活调控进光量(图2b)。
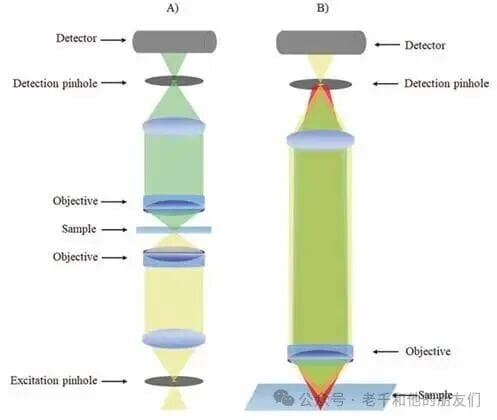
图2 共聚焦显微镜示意图。(a) 透射式共聚焦显微镜结构:激发针孔经物镜成像于样本焦点,探测物镜再将焦点处信号成像于探测针孔;(b) 针孔仅允许焦平面的激发光和荧光信号通过,如图所示,焦平面外产生的橙色和绿色光束会被探测针孔阻挡。
早期的针孔是固定在不透明材料上的静态圆孔,而现代仪器的针孔尺寸可自由调整,操作人员需在分辨率与信噪比之间寻找平衡——理论上针孔越小,过滤杂光的效果越好,分辨率越高,但透过的光量也越少,可能导致信号微弱。
实践证明,当针孔直径在50至200微米之间时,既能高效消除离焦光,又不会显著损失焦平面的可检测光,成为应用最广泛的参数。值得注意的是,针孔直径并非随意设定,必须与物镜产生的艾里斑(Airy disc)直径相匹配,才能最大化提升分辨率并减小光学平面厚度。
要理解艾里斑的作用,需先明确衍射现象。衍射是所有传播波的固有光学效应,当光遇到与自身波长(约 500 纳米)相近的孔径时,传播路径会被干扰扭曲。当光投射到带有小圆孔的屏幕上,在远处观察会形成特定的衍射图案:中心是一个明亮的圆形光斑,周围环绕着明暗交替的圆环,这一光强分布便是艾里斑(图 3a),由英国皇家天文学家乔治・比德尔・艾里首次描述。
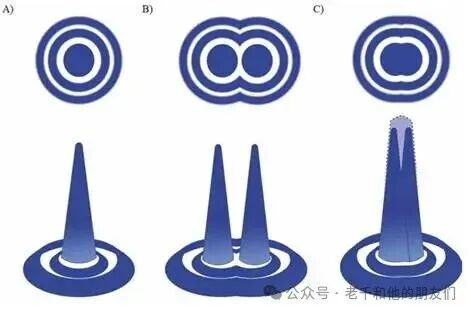
图3 圆孔衍射形成的艾里斑强度分布。(a) 圆孔产生的艾里斑;(b) 两个荧光分子若分离距离大于艾里斑中心峰值与第一暗环最小值的间距,则可被分辨;(c) 两个不可分辨荧光分子的强度分布图案。
在共聚焦显微镜的光学系统中,艾里斑的大小由光学组件的数值孔径和光的波长共同决定,它直接定义了焦点的最小尺寸,也决定了仪器的最大分辨率 —— 即样本上最小可分辨的特征尺寸。
显微镜领域广泛采用瑞利判据来界定分辨率:当两个等强度信号源的主强度峰值,恰好与另一个的第一个强度最小值重合时,这两个信号源被视为刚好可分辨(图 3b);若两个特征的距离小于这一临界值,它们的艾里斑会相互重叠,图像中便会呈现为一个形状扭曲的单一特征(图3c)。
对于共聚焦显微镜而言,其点扩散函数(PSF)—— 系统对单个点光源成像形成的三维光分布——在横向(沿焦平面)的分辨率约为 180-200 纳米,这一尺寸恰好能匹配生物样本中线粒体、核糖体等细胞器的大小,让这些微小结构的观察成为可能。
共聚焦显微镜的成像流程,离不开核心组件的协同工作。光源方面,它优先选用激光而非普通灯,因为激光具有高辐射亮度、单色性强的优势,且传播方向高度集中。
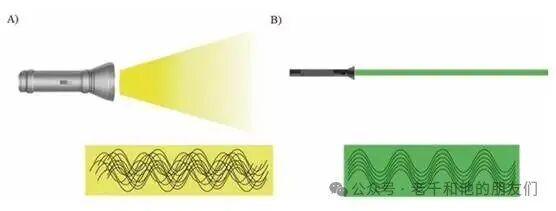
图4 光源传播示意图。(a) 非相干光源(灯泡)的光传播;(b) 相干光源(激光)的光传播。两图中波浪线代表光束中的单个光波。
激光器主要分为两类:连续波(CW)激光器输出能量稳定,如氩离子激光器可发射458、488、514纳米的蓝光,氦氖激光器能发出543、594、632纳米的红光,二者在生物样本成像中应用广泛;脉冲激光器则产生短光脉冲,持续时间从纳秒到飞秒不等,如钕:钇铝石榴石(Nd:YAG)激光器,这类激光器更多用于特定场景的成像。
激光的配置也极具灵活性,既可以从观察者对侧照射,也可采用外延照明,后者尤其适合不透明物体和荧光物体,在生物样本观察中,外延配置因能利用表面散射和反射光线,灵活性更高,已成为主流选择。
信号检测环节,现代共聚焦显微镜最常用的是光电倍增管(PMT)。当信号光子到达 PMT 的光电阴极时,会通过光电效应释放出一个电子;该电子在高压加速下,向一系列沿管排列的倍增极运动,每个倍增极都会通过二次发射释放更多电子 —— 相邻倍增极之间的电子动能可达 200 电子伏特,一个初始电子能释放 4至8个二次电子,这些二次电子又会在下一个倍增极继续产生新的电子,形成级联放大效应(图5a、b)。
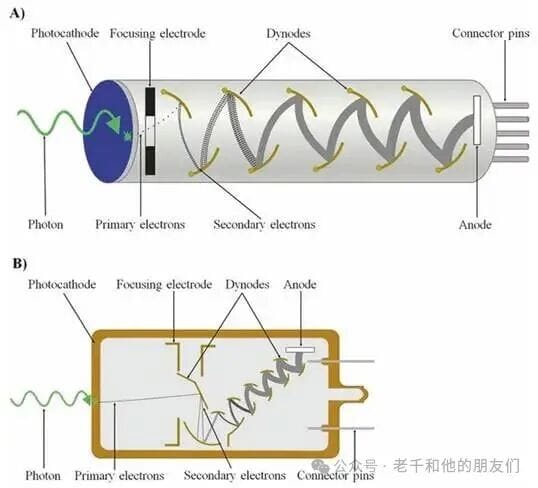
图5 共聚焦显微镜中常用的光电倍增管结构示意图。(a) 线性聚焦型光电倍增管(MCP-PMT);(b) 盒栅型光电倍增管。
倍增极链的总放大倍数通常在10⁶至10⁸之间,单个信号光子入射后,可产生约1 皮安的可测量电流。PMT的效率用量子效率(η)衡量,即光电阴极发射的光电子数与入射光子数的比值,这一参数与光电阴极的材料密切相关:多碱光电阴极(锑–钠–钾–铯组成)在紫外光到近红外光的宽光谱范围内都有高灵敏度,是基础配置的首选;砷化镓磷化物(GaAsP)光电阴极则在可见光区域表现更优,量子效率更高,但在紫外光区域性能较弱,适用于高精度成像需求。除了 PMT,光电二极管、固态电荷耦合器件(CCD)也可作为检测器,但应用范围远不及 PMT 广泛。
扫描系统是共聚焦显微镜生成图像的 “画笔”。早期仪器采用固定光学组件、移动样本的方式扫描,但样本架的惯性会导致平移速度慢,方向改变时还会出现振动,影响成像质量。现代仪器普遍采用激光束扫描方案:将小镜子安装在电流计(振镜)上,振镜响应施加的电流进行旋转,角位移与电流成正比(图6),两个振镜反射镜垂直安装在扫描头内,形成类似电视屏幕的光栅扫描模式。
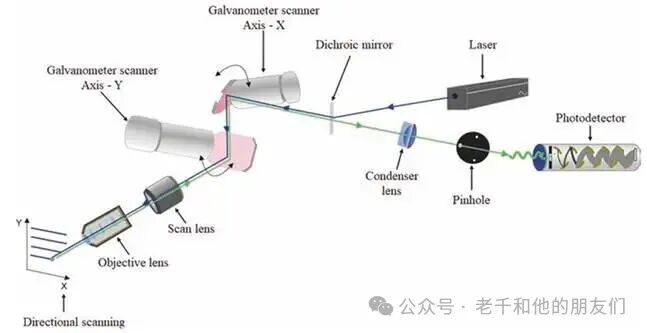
图6 激光扫描共聚焦显微镜(LSCM)的扫描头。安装在电流计上的反射镜(X-Y 轴)负责改变入射到样本上的激光束轨迹。
通常,水平轴(X 轴)的扫描速度比垂直轴(Y 轴)快100至1000 倍,扫描模式分为两种:一种是从视场左侧开始,到右侧后返回初始侧扫描下一条线;另一种是Z形扫描,到达线末端后反向扫描下一条线,直至回到初始侧。
若要获取三维图像,需通过移动载物台在Z轴方向额外扫描:先照明样本上的一个点,通过针孔记录信号(三维成像中称为体素采集);重复扫描形成平面点网格,再沿光轴移动焦平面,收集系列切片图像,最后通过软件合并生成三维图像。
不过,由于显微镜点扩散函数(PSF)呈椭圆形,并非各向同性,Z 轴方向的深度分辨率低于 XY 平面;同时,样本可能发生微小横向位移,导致不同平面的图像无法垂直对齐,形成配准误差,这也是三维成像中需要重点应对的问题。
荧光染料的选择直接影响共聚焦成像的质量与效果。传统的荧光素和罗丹明衍生物仍在广泛使用,而经过化学修饰的 N,N – 二甲基氨基类染料(詹妮莉亚荧光染料,Janelia Fluor),能通过异硫氰酸酯、琥珀酰亚胺酯等基团与目标分子的氨基、巯基结合,特异性更强。
花青染料(Cy2、Cy3、Cy3.5 等)以部分饱和的吲哚氮杂环核为基础,两个芳香环通过不同碳数的聚烯烃桥连接,其荧光激发和发射谱与传统染料相近,但水溶性、光稳定性和量子产率更高;亚历克萨荧光染料家族(Alexa Fluor 350、488、647 等)衍生自三(三乙基铵)-8 –羟基芘– 1,3,6 –三磺酸盐,与蛋白质结合后不会发生明显自猝灭,形成的偶联物更亮,且在大于 600 纳米的红光端表现优异,背景荧光更少,适合复杂样本成像。此外,硼二吡咯亚甲基(BODIPY)、超级亮染料(Supe Bright)等商用染料,也因各自的特性被应用于不同场景。
近年来,一些特殊类型的染料逐渐进入共聚焦成像领域。用于纺织和造纸工业的活性染料,如直接黄 96(又称二苯基亮黄素 7GFF、索洛苯基黄素 7GFE 等),适用于纤维素纤维及真菌、细菌、植物细胞的细胞壁相关分子,在蓝绿光波长范围内产生荧光信号,与碘化丙啶联用时,可在玉米(Zea mays)的染色根中分别标记细胞壁和细胞核,染色结构无重叠,成像效果清晰(图7)。
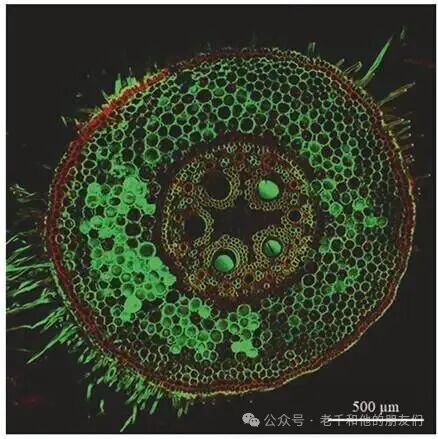
图7 经直接黄 96(Direct Yellow 96)和碘化丙啶(propidium iodide)染色的玉米(Zea mays)根。与荧光显微镜中使用的传统荧光染料相比,该样本在激光扫描共聚焦显微镜中表现出更优的性能和光稳定性。直接黄 96 染色细胞的细胞壁,碘化丙啶标记细胞核。
基于量子点(QD)纳米晶体的标记技术更是备受关注:量子点是尺寸1至10 纳米的球形半导体结构,核心为硒化镉(CdSe),表面包裹硫化锌(ZnS)壳层,其荧光发射光谱范围 350 至 750 纳米,具体波长由半导体颗粒直径决定。
量子点与蛋白质、抗体具有良好的生物相容性,荧光发射稳定,性能优异,但需通过 “配体交换”或“帽交换”进行功能化修饰——用亲水性配体(如含巯基、羧基的分子)取代表面的疏水性配体(三辛基膦、十六胺等),才能提高在水或缓冲液中的溶解性,进而与生物分子连接。
此外,HaloTag 和 SNAP-tag 等新型分子标记技术也在逐步推广:HaloTag 利用修饰后的卤代烷烃脱卤酶蛋白与合成配体共价结合;SNAP-tag 基于 DNA 修复相关的 O⁶- 烷基鸟嘌呤 – DNA 烷基转移酶(hAGT),可与多种荧光底物反应,更适合细胞计数和蛋白质表达的分析定量;而碱性品红(Basic Fuchsin)等经典染料被重新归类为荧光生成染料,在共聚焦显微镜下可快速测定草本植物细胞壁中木质素的空间丰度。
光漂白是共聚焦成像中无法回避的问题。在荧光现象中,荧光分子的电子受光刺激后跃迁至高能轨道,返回基态时释放可见光光子,但部分分子会因不可逆的断裂和修饰,丧失发光能力,这一过程便是光漂白(又称光解损伤)。
目前,人们对光漂白的机制尚未完全明确,现有理论认为,激发态荧光团可能与包埋介质中溶解的分子氧发生光动力相互作用,产生氧自由基,破坏荧光团的活性位点,这一反应在活细胞中取决于细胞生理状态,在固定细胞中则与代谢物和酶的区室化分布相关。
不同荧光染料的抗光漂白能力差异显著:用于观察内吞囊泡和液泡的两亲性苯乙烯基荧光染料 FM4-64(Synaptored C2),荧光寿命较短,容易发生光漂白;而常用于细胞核染色的 DAPI,在各类细胞和显微镜中都能长时间保持荧光稳定。为缓解光漂白,研究人员常使用抗褪色包埋介质,通过抑制酶活性、阻止自由基形成来稳定样本,但这类介质容易产生气泡和荧光背景等伪影;另一种方法是降低激发光功率,却又会受到样本发射效率的限制,如何平衡二者成为技术难点。
参考资料Confocal and Multiphoton Microscopy


