作者:孙千 本文转载自公众号:老千和他的朋友们。原文地址:https://mp.weixin.qq.com/s/oLe7r8QTg6ZK8FZ09zhk_g
与干燥和浓缩的材料样品不同,大多数生物样品都是含水的或水合的,含有大量的水分。它们质地柔软,由H、C、N、O、S和P等轻元素组成,且不具有导电性。因此,生物样品的制备需要多个步骤才能获得TEM样品。生物样品通常包括颗粒样品以及细胞和组织样品。
1、颗粒样品
如果样品是含有颗粒或纤维的液体溶液,可以在室温下通过负染色法制备,或在低温下通过快速冷冻法制备。
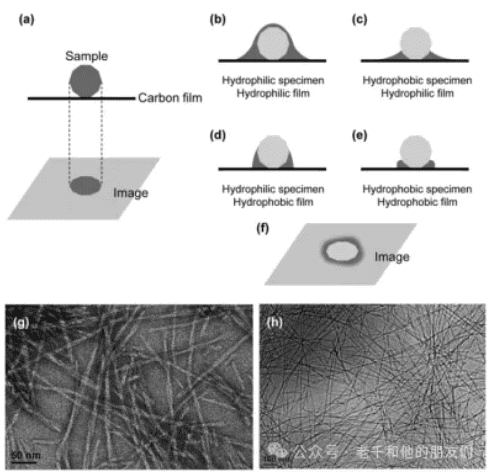
负染色过程如图1所示。通常情况下,未经染色的颗粒在TEM中呈现为暗色图像,这是因为颗粒散射和吸收入射电子(散射吸收对比度)。然而,含水样品不能直接放入TEM进行成像。负染色需要使用含重金属的化学物质来覆盖或部分覆盖颗粒,具体取决于样品、支撑膜和染料的性质。在任何情况下,当样品干燥后进行成像时,在TEM投影中,颗粒样品区域呈现较亮的对比度,因为其周围区域含有较厚的染料。因此,与常规图像相比,这种颗粒呈现相反的对比度。
负染色可以通过以下方法进行:
1. 准备染色液。
2. 对带有支撑膜的TEM载网进行辉光放电,以增加其亲水性。
3. 使用一对自闭式镊子夹住载网,在载网上放置1-3μL样品溶液。用滤纸吸去多余的样品液体。
4. 约10秒后,缓慢移液20μL染料(醋酸铀、磷钨酸、硅钨酸钠)。在向载网上移液时,用滤纸条轻轻吸取对面的染料。吸去载网上的多余液体。
5. 将载网在空气中干燥。
也可以在石蜡膜表面放置一滴(约100mL)染色液,在上述步骤4中,将TEM载网翻转并使其漂浮在染色液的表面上20秒,然后取出并在空气中干燥。
另一种负染色方法是将样品溶液和染料按1:1比例混合,然后将混合溶液施加到载网上。
样品也可以进行正染色,使染料与样品形成复合物,这样颗粒在TEM中呈现暗色对比度。这样,正染色会增加样品的电子不透明度,使样品呈现更暗的颜色,而负染色的样品相对于周围的染料仍然保持较高的电子透明度。负染色在实验室实践中已经成为常规使用的方法。
图1(g)显示了使用2 wt.%醋酸铀水溶液进行负染色制备的水凝胶形成肽的TEM图像。纳米纤维相对于周围区域呈现较亮的对比度。作为对比,图1(h)显示了通过快速冷冻制备并在低温下成像的纳米纤维。这些纤维被包埋在冰中,没有使用其他化学物质,因此呈现较暗的对比度。
2、细胞和组织样品
生物细胞和组织样品含有大量的水分。为了在高真空TEM中观察样品,样品固定是最重要和最关键的步骤之一。通过适当的固定,细胞或组织的超微结构可以尽可能地保持接近活体样品的状态。样品可以在室温下通过化学固定进行经典制备,或在低温下通过冷冻固定进行冷冻制备。制备TEM样品需要多个步骤,如图2所示。
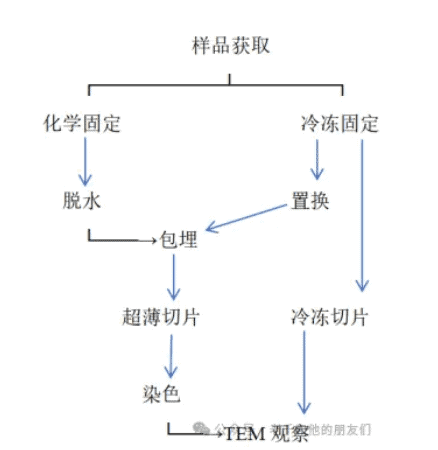
经典的室温制备包括以下步骤:
1.样品提取。用刀取出一小块具有代表性的样品(尺寸约为厘米级),如图3(a)所示。
2. 固定。包括以下步骤:
3. 脱水。样品通过丙酮或乙醇系列进行脱水,步骤如下:50%乙醇(10分钟)→70%乙醇(10分钟)→80%乙醇(10分钟)→90%乙醇(10分钟)→95%乙醇(10分钟)→100%乙醇(20分钟)→100%乙醇(20分钟)。
4. 置换。仅使用环氧丙烷(PO)并更换液体两到三次(每次20分钟)。
5.包埋。使用新配制的树脂包埋样品(图3d)。将样品放入硅胶包埋板的孔中,将树脂倒在组织上。确保树脂中没有气泡。根据所用树脂的具体要求在适当条件下使树脂聚合。
6. 超薄切片。
7.染色。用重金属盐(醋酸铀和柠檬酸铅溶液)进行后染色可以增强对比度。在封口膜上放一滴醋酸铀溶液,将载网薄切面朝下漂浮在液滴上与染料反应10分钟(图3e)。用水轻轻冲洗。将载网在柠檬酸铅溶液液滴上染色10分钟,然后用水轻轻冲洗并风干。
8. TEM观察。生物样品通常在较低电压(80-120 kV)下观察以增强对比度,而在大多数情况下,生物样品不需要高分辨率,因此可以使用较低电压。
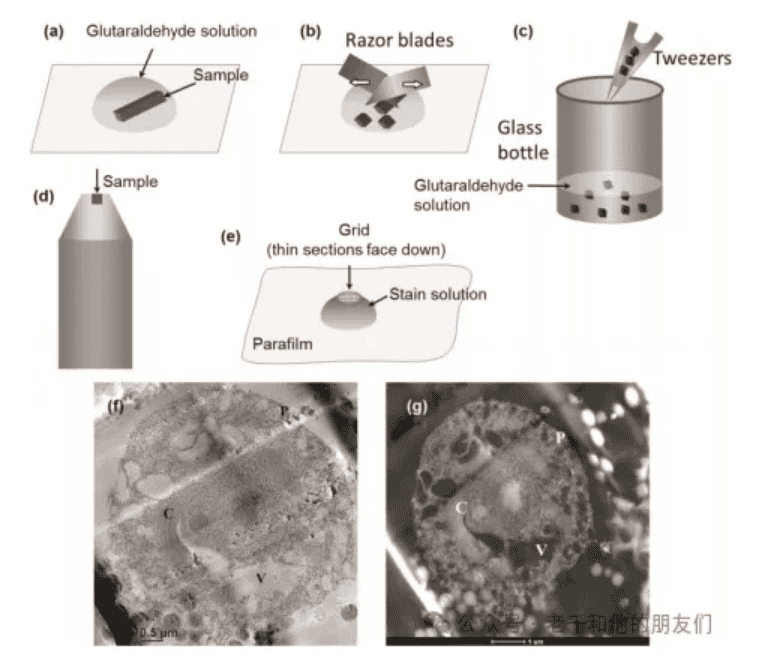
图3f(TEM)和图3g(STEM)展示了单个金藻细胞的示例。简而言之,液态藻类样品首先与Trump固定液混合,然后通过0.45微米孔径的塑料滤膜过滤,使细胞停留在滤膜表面。随后将细胞在1%(毫克/毫升,重量体积比)四氧化锇(溶于0.1 M HEPES缓冲液,pH 7.4)中染色约0.5小时,并通过甲醇(10%-100%)脱水。之后,将其包埋在环氧树脂中并切成100纳米厚度的切片用于TEM和STEM分析。在低倍率下可以观察到细胞附着在滤纸上。
参考资料
Luo, Z. (2016). A practical guide to transmission electron microscopy : fundamentals (First edition). Momentum Press.
J.J. Bozzola, L.D. Russell. Electron Microscopy: Principles and Techniques for Biologists. Jones and Bartlett Learning, Massachusetts, 1999
欢迎关注孙千老师的公众号



