作者:孙千 本文转载自公众号:老千和他的朋友们。原文地址:https://mp.weixin.qq.com/s/ST1AcLSSOesSG2z5dS2OZw
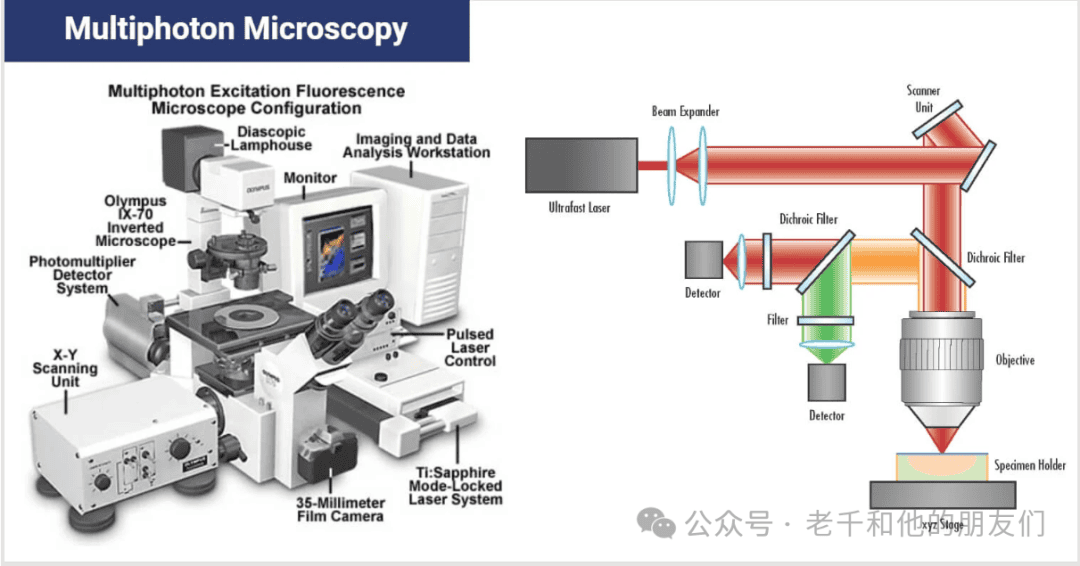
与共聚焦显微镜依赖针孔过滤杂光不同,多光子激光扫描显微镜(Multiphoton Laser Scanning Microscopy,简称MPLSM,或多光子显微镜)以非线性光学现象为对比度机制,通过两个或多个光子的联合作用产生样本信号,常见的非线性效应包括双光子激发荧光(TPEF)、二次谐波产生(SHG)、三次谐波产生(THG)和相干反斯托克斯拉曼散射(CARS)等。
非线性光学现象的本质,是光在极高强度下与介质的相互作用——在线性光学领域,光不会改变自身颜色,也不会与其他光束相互作用;但在高强度光场中,介质的响应不再呈线性,会产生一系列新的光学效应。
要理解非线性光学,可从原子中电子的经典模型入手。所有物质的原子都包含带正电的原子核和环绕其的电子壳层,价电子因离原子核最远,结合力最弱,最易受光的影响。未受扰动时,价电子处于势能场的最低状态,平衡位置附近的势能可近似为抛物线,电子受到的力遵循胡克定律,呈线性特征(图1蓝线及插图红线)。
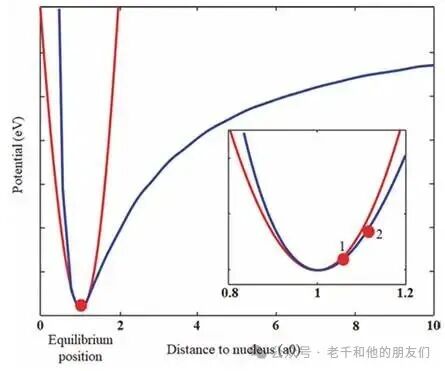
图1 电子势能随与原子核距离变化的示意图。插图为平衡位置的放大视图,红点代表电子。
当普通强度的光波入射,电子会在平衡位置附近产生微小扰动,运动呈简谐振动,这也是线性光学现象的基础;若入射光的振幅大幅增加,电子的位移会超出抛物线近似范围(图1插图位置 2),此时需要用抛物线势能加三次势能的高阶项来描述原子势能,电子的运动呈现非简谐振动,这便是非线性光学的研究范畴。在这种情况下,光的颜色可能发生改变,二次谐波产生(SHG)就是典型例子 —— 绿色激光入射后,可能产生波长减半的蓝光信号。
最常见的多光子显微镜技术是双光子激发荧光(TPEF)。1931 年,玛丽亚・格佩特–梅耶(Maria Goeppert Mayer)在博士论文中首次从理论上提出双光子吸收的概念,30 年后,凯泽(Kaiser)通过实验观察到这一效应;巧合的是,1961年,弗兰肯(Franken)发表了二次谐波产生(SHG)的首次实验报告。为纪念Goeppert Mayer的贡献,双光子吸收截面的计量单位以她的名字命名,1个格佩特–梅耶(1 GM)定义为10−50 cm4 s photon−1。
上世纪 70 年代中期,谢泼德(Sheppard)及其同事发现,激发光学非线性效应所需的极高强度,仅能在物镜的焦体积内实现,这一发现奠定了多光子显微镜光学切片能力的基础;1990 年,登克(Denk)、斯特里克勒(Strickler)和韦伯(Webb)发明了第一台双光子激光扫描荧光显微镜,此后该技术迅速发展,成为深层组织成像的核心工具。

从量子力学角度看,线性荧光与双光子激发荧光的过程既有相似之处,也存在本质区别。
线性荧光中,电子的能量只能取离散的能级值,最低能级为基态,分子的振动、转动会形成能级亚层(图2 细线)。光入射时,光子携带的能量(E=hνₑₓc)与基态和激发态的能量差(Δₑₓc)相等,电子会在几飞秒内从基态跃迁至激发态(图2b);几皮秒后,电子通过非辐射弛豫将部分能量传递给转动 – 振动能级,降至激发态最低亚层(图2c);随后在荧光寿命(皮秒至数纳秒)内,电子返回基态并发射光子,发射光子能量(hνₑₘ)等于激发态最低能级与基态的能量差(Δₑₘ)(图2d)。
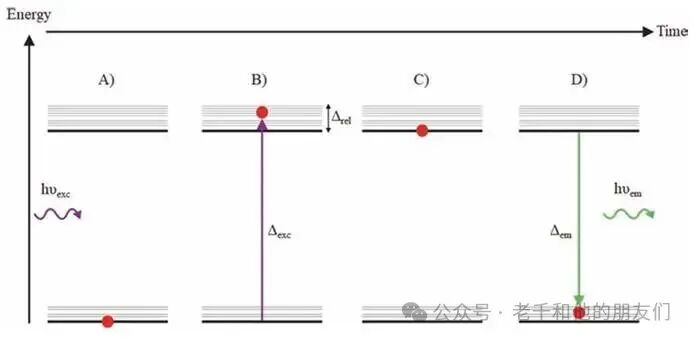
图2线性荧光过程的一系列事件。(a) 电子处于基态,入射激发光子;(b) 电子吸收激发光子后,跃迁到转动 – 振动激发态;(c) 电子弛豫到激发态多重态的最低转动 – 振动能级;(d) 电子通过发射频率为 νₑₘ的荧光光子弛豫回基态。
双光子激发荧光的初始吸收过程则是吸收两个相同频率的光子,中间涉及虚态(图3虚线),而非真实能态,因此吸收过程瞬时完成(亚飞秒时间尺度);但电子最终会跃迁至系统的真实激发态,之后通过非辐射弛豫降至激发态最低能级,停留数百皮秒至数微秒后返回基态,发射光子的能量小于两个吸收光子的能量之和,且发射呈360°全方位分布(立体角4π球面度),与二次谐波产生的定向发射截然不同。
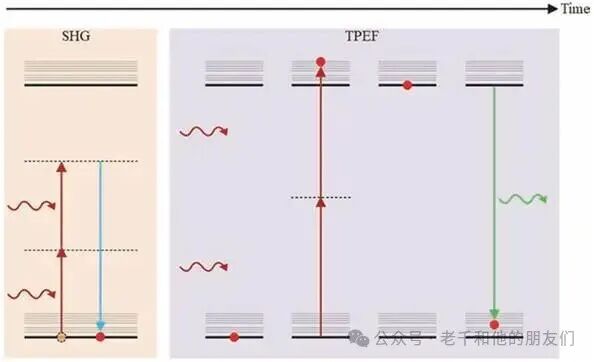
图3 二次谐波产生(SHG)和双光子激发荧光(TPEF)过程的一系列事件。左面板:二次谐波产生的发射过程 —— 电子在两个入射光子提供的能量作用下被激发到虚态(注:νₑₘ=2νₑₓc);右面板:双光子激发荧光的发射过程 —— 其序列与线性荧光相同,但同时吸收两个光子。
二次谐波产生(SHG)是多光子显微镜中仅次于 TPEF 的常用技术。这一效应仅在非中心对称材料中存在,无需外部发色团,信号直接来自介质的非线性光学性质,属于内源性成像技术。在生物学领域,SHG 显微镜已广泛用于胶原蛋白成像,近年来也成功应用于微管成像(图4、图5),其对有序结构的探测能力,使其在生物材料和晶体材料研究中具有独特优势。
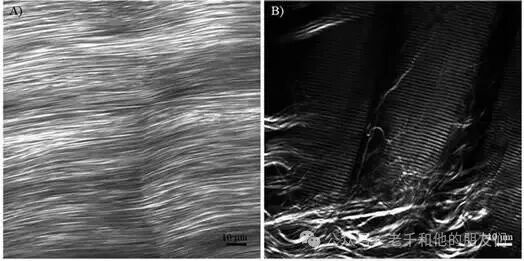
图4 胶原蛋白和肌球蛋白的二次谐波产生(SHG)成像。(a) 肌腱的图像;(b) 大鼠腓肠肌肌腱连接处的图像。
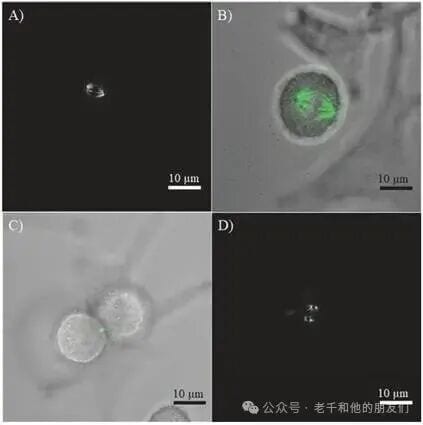
图5 细胞分裂过程中微管的可视化。(a) 分裂中的 HeLa 细胞有丝分裂纺锤体微管的二次谐波产生(SHG)信号;(b) 明场图像(灰色)与二次谐波产生信号(绿色)的叠加图;(c) 刚完成分裂的两个细胞的细胞间桥微管的二次谐波产生信号(绿色);(d) 不同位置的有丝分裂纺锤体的二次谐波产生信号。
非线性现象的激发需要极高的光强度,而这一强度只能通过聚焦激光束实现。光的强度是空间和时间能量密度的度量,单位为每单位面积的瓦特数,与光子能量、入射光子数量直接相关。高功率并不等同于高强度,若能量分布在大面积或长时间内,强度会显著降低。
脉冲激光器的出现解决了这一问题——其脉冲持续时间极短,可将能量高度集中在瞬间。以常用的钛蓝宝石(Ti:Sapp)激光器为例,每秒发射8000万个脉冲,每个脉冲持续时间约100飞秒(1飞秒 = 10⁻¹⁵秒);将1毫瓦的该激光器通过数值孔径 0.5 的物镜聚焦,焦斑直径约 1 微米,强度可达 7.96×10⁹瓦特/平方厘米,是同功率连续波激光器(6.4×10⁵瓦特 / 平方厘米)的 10,000 倍,足以激发非线性效应。
多光子显微镜的光源主要包括三类:钛蓝宝石激光器、光学参量振荡器(OPO)和光学参量放大器(OPA)。
钛蓝宝石激光器的可调谐范围为 650 至 1080 纳米,脉冲持续时间 10 至 200 飞秒,调谐至 800 纳米时输出功率最高,可达 1 至 3 瓦特;但脉冲持续时间低于 80 飞秒时,因包含多种频率光,易受光学元件折射率影响发生畸变,需进行色散补偿,且可调谐范围会受限。
OPO 和 OPA 并非严格意义上的激光器,其工作原理是非线性相互作用,而非受激辐射,它们以钛蓝宝石激光器的脉冲为 “种子”,可将波长转换并放大,可调谐范围达 300 至 20,000 纳米,能覆盖钛蓝宝石激光器无法企及的光谱区域。不过,这些超短脉冲光源的成本极高,占多光子显微镜总造价的 30% 至 50%,成为该技术普及的主要障碍。
光学切片是多光子显微镜的核心特征,也是其生成高质量三维图像的关键。当使用非线性效应作为对比度机制时,信号仅在焦体积内产生,该焦体积由物镜的横向和轴向分辨率决定,通常仅为几飞升(1飞升 = 10⁻¹⁵升)。
相比之下,线性荧光成像中,激发光在样本内的整个传播路径都会诱导荧光产生,收集到的光来自光的传播路径而非单一光点,导致图像模糊;而多光子显微镜的信号产生被精确局限于特定点,每个像素(或三维成像中的体素)收集的光都能与样本的特定物理点对应,这一特性不仅让三维成像更精准,还能实现三维光学组织学 —— 对大型样本的一个切片成像后,将光强提高到样本烧蚀阈值以上,物理移除已成像切片,重复该过程即可完成完整三维重建。
近红外光(NIR)的使用,让多光子显微镜在深层组织成像中具备了无可比拟的优势。700至1000纳米的近红外光谱区域被称为 “光学窗口”,生物组织在该范围内吸收较低,相对透明——这也是将手指放在强白光光源上时,组织呈现红色的原因;同时,散射强度与光的波长密切相关,长波长光的散射强度比可见光、紫外光低一个数量级。这两种特性共同作用,使激发光的穿透深度大幅增加,文献报道可对深度达1毫米的神经元进行成像,远超共聚焦显微镜的几十微米穿透深度。
此外,近红外光替代了紫外光激发,避免了紫外辐射对细胞和组织的光毒性,可长时间观察样本而不造成损伤;同时,焦体积外的荧光团不会被激发,光漂白现象显著减少,进一步延长了观察时间,这对于活体样本成像尤为重要。
与共聚焦显微镜相比,多光子显微镜的优势十分显著:光漂白程度更低、观察时间更长、光毒性更小、组织穿透更深、背景噪声更少(得益于光学切片能力和散射减少)、信号损失更少(无需针孔过滤,避免了散射光子被阻挡的问题)。
但它也存在明显劣势:超短脉冲激发光源成本高昂、结构复杂,仪器整体价格远高于共聚焦显微镜;在相同操作条件下,其点扩散函数更大,横向分辨率略低于共聚焦显微镜。
此外,两种仪器的结构也存在一些差异:共聚焦显微镜通常使用二极管激光器,多光子显微镜则用超短脉冲激光器或 OPO;多光子显微镜无需激发针孔和检测针孔,简化了设计与校准,但物镜需针对近红外光优化抗反射涂层,反射镜涂层也需替换为近红外光专用类型。
超短激光脉冲的色散补偿是多光子显微镜使用中的关键技术问题。超短脉冲由多种不同频率的光组成,当穿过光学元件时,不同频率光的传播速度不同(低频光速度高于高频光),会导致脉冲在时间上被拉伸,强度降低(图6)。为解决这一问题,需使用压缩器装置:让低频光的传播距离长于高频光,补偿色散效应,确保脉冲到达样本时仍保持短脉冲状态,以维持足够的激发强度。
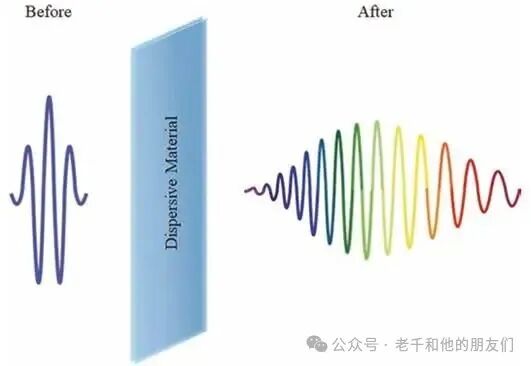
图6 材料色散导致脉冲拉伸的示意图。入射脉冲由多种频率的光组成,这些光共同传播;在材料内部,低频光的传播速度高于高频光;脉冲离开材料后,会在时间上被拉伸,不同频率的光会在脉冲内的不同时间出现。
多光子显微镜光谱学:无损分子鉴定与动态追踪
在生物科学和材料科学领域,研究人员对能精准描述细胞细胞器区室化内源性分子、或封装在生物聚合物基质(如纳米颗粒、微米颗粒)中合成分子的工具需求日益增长。
高效液相色谱(HPLC)是传统的间接分子鉴定和定量方法,但处理步骤复杂,样品前处理、流动相配比等环节的微小误差,都可能导致结果出现较大偏差。多光子显微镜光谱学的出现,提供了一种快速、无损、无创的解决方案 —— 通过光谱指纹(SF)鉴定分子,无需复杂样品处理,能在保持样本完整性的前提下获取分子信息。
光谱指纹是分子的 “光学身份证”,每种分子的光谱指纹都具有唯一性,且在样本中保持稳定。
植物和绿藻的光合组织中,叶绿素是主要的自发荧光色素;人类皮肤和头发的颜色则由棕色真黑素和黄红色褐黑素共同决定,这两种色素的相对比例会随生长阶段、生理状态和环境适应发生变化,因此光谱指纹可作为疾病诊断、生态相互作用研究、代谢组学分析的参考依据。
在植物组织中,多个具有自发荧光的化合物可能共存于同一个细胞,它们的吸收光谱和量子产率(QY)不同,容易导致发射峰重叠,影响鉴定准确性。解决这一问题的关键在于钛蓝宝石激光器的高分辨率调谐能力 —— 可在不同波长下以 1 纳米的分辨率精准调谐,通过改变激发波长并结合解混技术,揭示原本重叠的光谱特征;同时,双光子激发产生的散射更少,三维空间分辨率优异,还能减少光损伤,进一步提升光谱鉴定的准确性。需要注意的是,单光子激发与双光子激发产生的指纹荧光光谱存在差异,实际应用中需根据激发方式调整分析参数。
现代多光子显微镜的高光谱成像通常被称为 Lambda 模式,启用该模式时,显微镜的内部配置会发生特定变化:信号经过收集针孔后,被发送至一个棱镜,棱镜将复合光分散为不同波长的单色光;棱镜后方是安装在平移台上的电动狭缝,狭缝孔径决定透射的光谱带宽,平移台则用于将狭缝对准目标波长;选定带宽和中心波长后,信号被传送至多通道光电倍增管(通常由 32 个元件组成),该装置本质上是一个光谱仪,能在 350 至 750 纳米的可见光区域,以 1、5、10 纳米的带宽步长记录信号。
另一种配置是在棱镜后直接使用多通道检测器,无需电动狭缝,适用于快速光谱采集。通过选择合适的参数,可分离含有多种荧光团的样本产生的荧光(前提是各荧光团发射光谱不同),利用光谱信息解混光谱通道,构建多光谱通道图像,且不会限制图像采集效率。
高光谱成像的应用场景十分广泛。在淡水生态系统研究中,可通过该技术分析藻类群落与细菌的共生关系:绿藻的叶绿素光谱主要集中在 613 至 713 纳米,细菌群落的光谱则集中在 413 至 433 纳米的蓝光区域,通过解混通道可清晰区分二者的分布(图7a-f)。
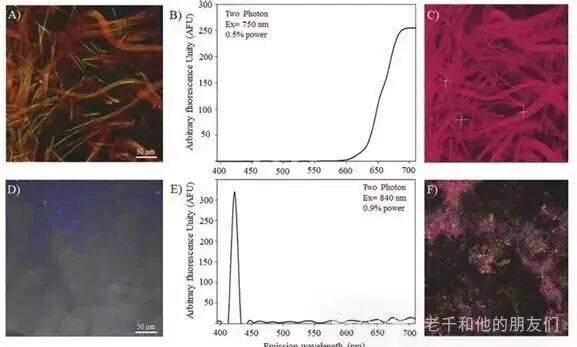
图7 多光子显微镜的 Lambda 模式分析。(a) 藻类群落的荧光图像;(b) 对应叶绿素色素的光谱曲线;(c) 解混通道后的原始图像,显示恢复的图像;(d) 相比之下,细菌群落在蓝光区域显示荧光;(e) 光谱图显示发射峰位于可见光的蓝光区域;(f) 解混通道的原始图像,显示恢复的数据。
在纳米技术领域,罗丹明 B(rhodamine B)和曙红 Y(eosin Y)等荧光染料,在双光子激发下的本征光谱曲线稳定,即使暴露于不同环境条件也不会发生显著变化,常被用于标记纳米颗粒;将这些标记后的纳米颗粒施用于植物和动物,可追踪其在细胞中的动态分布 —— 例如,用罗丹明 B 标记的纳米颗粒施用于玉米(Zea mays)幼苗后,多光子显微镜能清晰观察到纳米颗粒从水介质进入根髓的内化过程,以及在生物体组织深处的积累情况(图8a)。
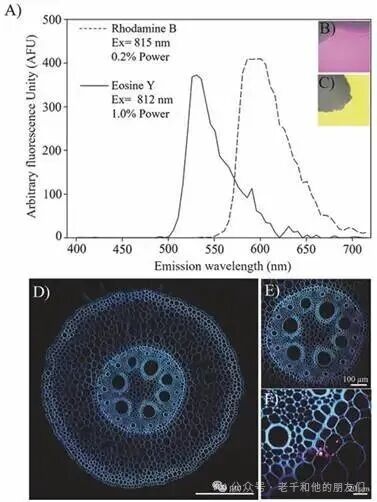
图8 多光子显微镜中通过 Lambda 模式表征多种染料的光谱。(a) 罗丹明 B(rhodamine B)和曙红 Y(eosin Y)的光谱曲线;(b) 罗丹明 B 染色的图像;(c) 曙红 Y 染色的图像;(d) 用罗丹明 B 染色的纳米颗粒标记的玉米幼苗图像;(e) 根部维管柱的特写图像;(f) 显示根中柱的图像 —— 纳米颗粒不可见,它们被限制在凯氏带和内皮层之间。
共聚焦显微镜 VS多光子显微镜
共聚焦显微镜与多光子显微镜均基于激光扫描技术,是光学成像领域的里程碑式创新。
共聚焦显微镜以针孔共焦设计为核心,通过精准过滤离焦光,结合连续波激光、PMT 检测器和多种荧光染料,实现了表面和浅层样本的高分辨率三维成像,横向分辨率可达 180-200 纳米,在细胞表面结构、细胞器形态观察中具有不可替代的优势,但受限于光漂白和穿透深度,且需依赖外部染料标记。
多光子显微镜则借助非线性光学现象,以超短脉冲近红外激光为激发源,无需针孔设计,在深层组织成像(可达1毫米)、长时间活体观察和内源性信号检测方面表现突出,光毒性和光漂白显著降低,其光谱学应用更拓展了无损分子鉴定与动态追踪的边界,但仪器成本高昂,技术门槛较高。
两种技术各有侧重、互补共生,它们的出现极大地推动了生物医学、材料科学等领域的发展——从细胞内细胞器的精细结构观察,到深层组织的三维重建,从分子水平的光谱鉴定,到纳米颗粒的体内追踪,为科研人员提供了前所未有的微观视角,成为探索生命奥秘和材料特性的强大工具。随着光学组件、光源技术和信号处理算法的不断进步,这两种显微镜的性能将持续提升,应用场景也将进一步拓展,为相关学科的发展注入新的动力。
参考资料
1 Confocal and Multiphoton Microscopy
2 Multiphoton Microscopy | Edmund Optics
3 Molecular Expressions Microscopy Primer: Specialized Microscopy Techniques – Fluorescence – Multiphoton Introduction


